ميديكال إكسبريس
حدد فريق دولي من العلماء التغييرات الهيكلية الدقيقة في بروتين "سبايك" لمتحور "أوميكرون".
وتشرح ملاحظاتهم كيف يكون الفيروس قادرا على التهرب من الأجسام المضادة ضد المتغيرات السابقة وما يزال شديد العدوى.
وقال ديفيد فيسلر، الباحث في معهد هوارد هيوز الطبي وأستاذ الكيمياء الحيوية المساعد في معهد هوارد هيوز الطبي، في كلية الطب بجامعة واشنطن في سياتل، والذي قاد البحث مع غيورجي سنيل من شركة Vir Biotechnology في سان فرانسيسكو: "تقدم النتائج مخططا يمكن للباحثين استخدامه لتصميم إجراءات مضادة جديدة، سواء كانت لقاحات أو علاجات، ضد "أوميكرون" ومتحورات فيروس كورونا الأخرى التي قد تظهر".
ونشر الفريق، بمشاركة المؤلفين الرئيسيين للدراسة ماثيو ماكالوم، زميل ما بعد الدكتوراه في مختبر فيسلر، ونادين كزودنوشوفسكي، عالمة التكنولوجيا الحيوية في فير، النتائج التي توصلوا إليها في مجلة Science.
وتسبب متحور "أوميكرون"، الذي وقع تحديده لأول مرة في نوفمبر 2021 في جنوب إفريقيا، في زيادة عدد الإصابات في جميع أنحاء العالم. وبالإضافة إلى كونه شديد العدوى، يمكن للمتحور أن يتجنب الأجسام المضادة ضد المتحورات السابقة ما يؤدي إلى حدوث عدوى بين أولئك الذين وقع تطعيمهم وأولئك الذين أصيبوا سابقا.
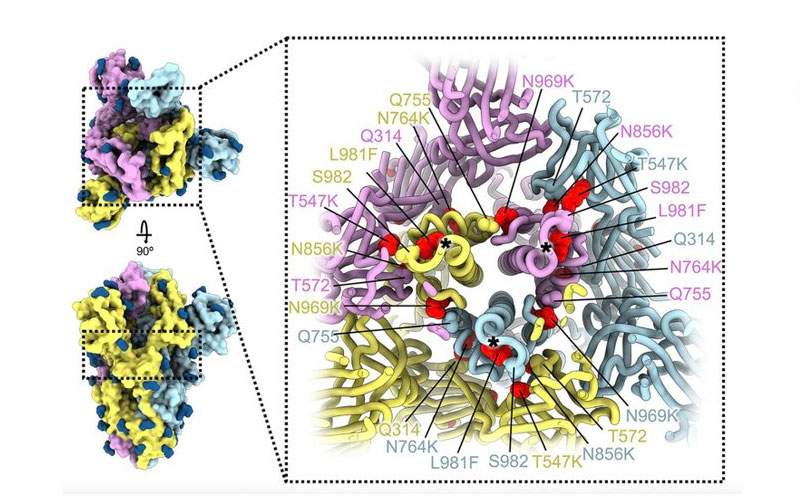
ويُعتقد أن عدوى الفيروس ناتجة جزئيا على الأقل عن العدد الكبير من الطفرات في تسلسل الأحماض الأمينية لبروتين "سبايك" في الفيروس. ويستخدم الفيروس بروتين "سبايك" للالتصاق بالخلايا التي يصيبها ودخولها. ويحتوي بروتين "سبايك" لـ"أوميكرون" على 37 طفرة تميزه عن عينات SARS-CoV-2 الأولى في عام 2020.
وأظهرت الأبحاث السابقة التي أجراها فيسلر وزملاؤه أن الأجسام المضادة التي تولدها اللقاحات الأكثر شيوعا، وجميع الأجسام المضادة أحادية النسيلة المستخدمة حاليا لعلاج الالتهابات، باستثناء واحد منها، لديها قدرة مخفضة أو ملغاة لتحييد "أوميكرون".
لكن العديد من الطفرات في المتحور تؤثر على بنية منطقة بروتين "سبايك" المسؤول عن الارتباط بالخلايا والدخول إليها، وهي منطقة تسمى مجال ربط المستقبلات، وتوقع الكثير أن التغييرات الناتجة في بنية مجال ربط المستقبلات قد تضعف قدرة المتحور على الارتباط بهدفه على الخلايا.
وهذا الهدف هو بروتين يسمى الإنزيم المحول للأنجيوتنسين 2، أو ACE2. ومع ذلك، وجد فيسلر وزملاؤه في دراستهم أن التغييرات زادت بالفعل من قدرة مجال ربط المستقبلات على الارتباط بـ ACE2 بمقدار 2.4 ضعفا.
ولفهم كيفية تراكم العديد من الطفرات لـ"أوميكرون" مع الاحتفاظ بالتفاعلات الفعالة مع المستقبل المضيف ACE2، استخدم فيسلر وزملاؤه دراسات مجهرية إلكترونية مجهرية والأشعة السينية للكشف عن التنظيم ثلاثي الأبعاد لبروتين "سبايك" في "أوميكرون". وسمح لهم هذا النهج بتمييز شكل لبنات بناء الأحماض الأمينية الفردية التي تشكل بروتين "سبايك".
وحدد الباحثون أيضا كيف أثرت التغييرات الهيكلية في بروتين "سبايك" على قدرة الأجسام المضادة الفعالة ضد المتحورات السابقة على الارتباط بـ"أوميكرون".
وباستخدام هذه التقنيات، كشف العلماء كيف غيّرت الطفرات كيفية تفاعل البروتين مع الأجسام المضادة بحيث يتم تقليل قدرة جميع الأجسام المضادة وحيدة النسيلة تقريبا ضده، بينما، في الوقت نفسه، يتم تحسين قدرة مجال ربط مستقبلات "سبايك" على ربط ACE2.
وكان التأثير العام هو تمكين مجال ربط المستقبلات من تجنب الأجسام المضادة التي تستهدفه والارتباط بـ ACE2 بشكل أكثر إحكاما.
وتظهر النتائج ما هو الخصم الهائل SARS-CoV-2، كما يقول فيسلر، مشيرا إلى أن "هذا الفيروس له مرونة لا تصدق: يمكنه أن يتغير كثيرا ولا يزال يحافظ على جميع الوظائف التي يحتاجها للإصابة والتكاثر. ومن المؤكد تقريبا أن أوميكرون ليس هو المتحور الأخير الذي سنراه".
وقال فيسلر إن الهدف من الأبحاث المستقبلية يجب أن يكون التركيز وتحديد مناطق إضافية على بروتين "سبايك" لا يمكن تغييرها دون التسبب في فقدان البروتين لوظيفته. وبسبب أهميتها، تميل هذه المناطق إلى البقاء محفوظة حتى مع تحور أجزاء أخرى من البروتين.
ولذلك من المرجح أن تظل هذه المناطق المحفوظة من البروتينات الفيروسية دون تغيير في أي متغير جديد قد يظهر. وشرح فيسلر أن هذه المناطق ستضع أهدافا مثالية للقاحات والعلاجات الجديدة التي يمكن أن تكون فعالة ليس فقط ضد المتحورات الجديدة ولكن ضد فيروسات الجنس الفرعي لفيروس كورونا ساربي (Sarbecovirus) الجديدة، وهي مجموعة الفيروسات التي تضم SARS-CoV-2 وSARS-CoV.